正当 疫情稍稍缓和,即将迎来春暖花开之际,全球疫情却突然大爆发, 物流、防疫物资的货源供应开始出现大逆转。新冠肺炎在全球蔓延,而 市场依然离不开 产品和 市场。
之前我们讲述了《一只口罩的“秘密”,出口何去何从?》,得到了社会各界的聚焦关注,我司的“防疫物资外贸专项小组”接到无数的客户热线,并成功协助海外客户采购到符合进口国资质要求的口罩。
除了口罩, 国内防护物资——防护服 也面临产能过剩, 内需转出口的情况, 结合 促外贸稳增长的政策措施,现就防护服的出口通关要求及国外主要技术性贸易措施做出如下汇总:
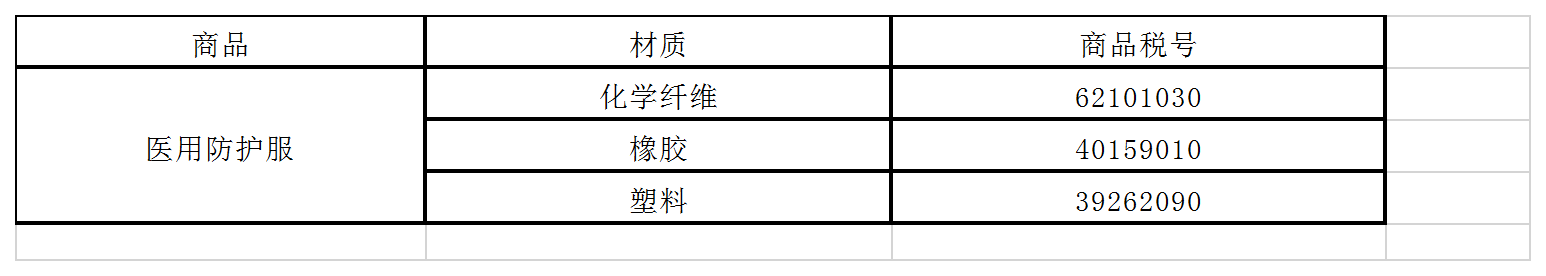
一、商品归类:
除特殊情况外,绝大部分防护服按照材质分类应归入下列税号:
二、禁限管理:
目前商务部未对防护服设置贸易管制要求, 海关也无针对防护服物资的监管证件口岸验核要求。
三、出口退税:
防护服的出口退税率为13%。
四、原产地优惠:
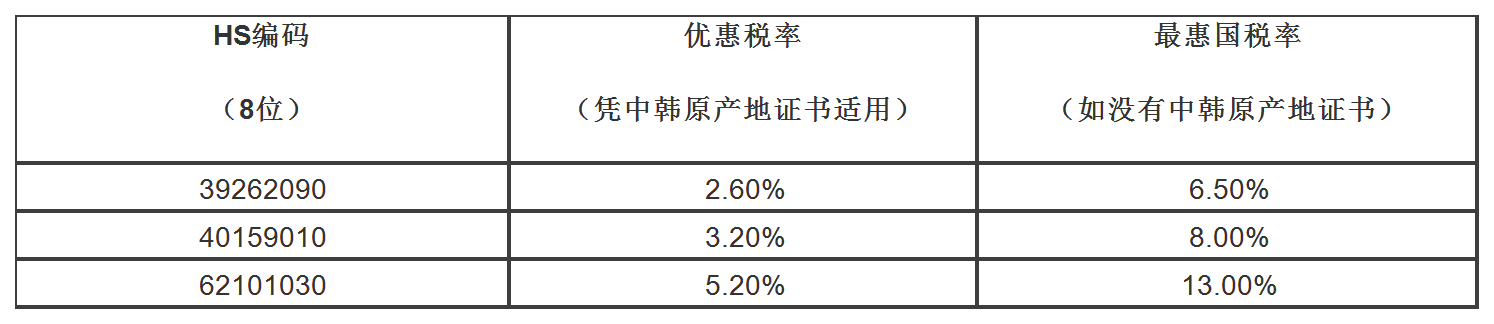
已经和25个 或地区签署了17个自由贸易协定, 原产的商品,包括疫情防控物资,出口到这些 和地区凭优惠原产地证书可以获得关税减免优惠。
以出口防护服到韩国为例,可以看到关税减免的幅度是很大的,所以建议出口前向海关申请原产地证书。
疫情防控需要的防护服出口涉及的公司资质证明材料与出口口罩基本相同,可参见《促外贸稳增长——口罩出口贸易指南》
五、产品准入条件:
必须要取得美国食品和药物管理局FDA注册认证才可以在美国本土市场进行销售。

防护服分类:
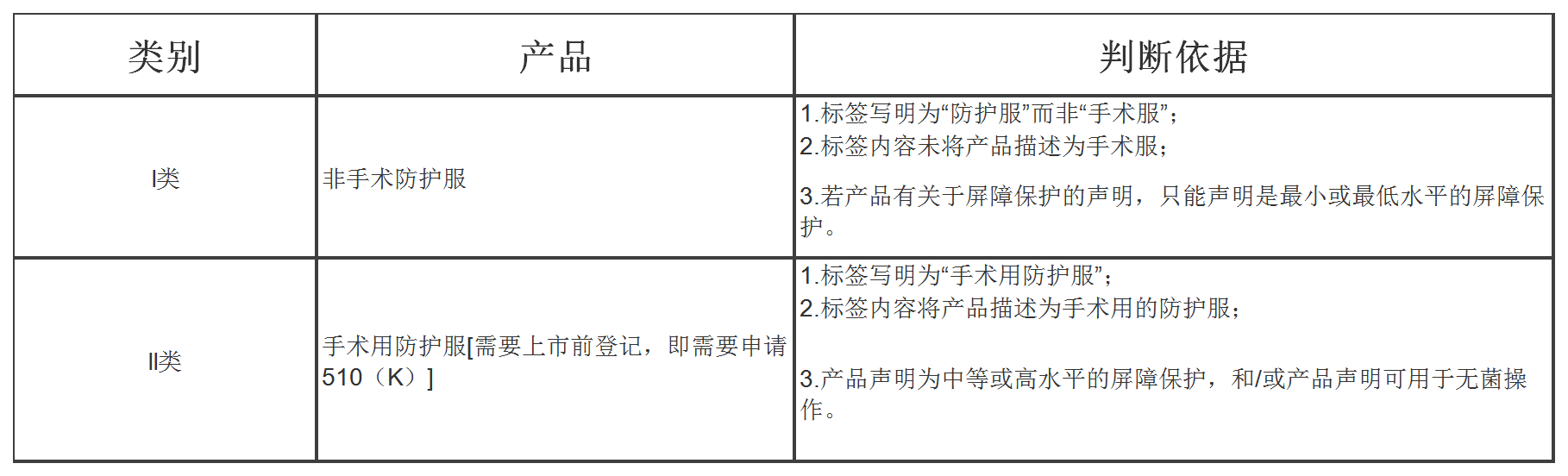
美国医用防护服可分为非手术防护服和手术用防护服两类。非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510(K)。I类和II类医用防护服的判断依据见下表。
医用防护服分类及判断依据:
2004年,FDA认可了美国 标准学会/美国医疗器械促进协会标准ANSI/AAMI PB70《医疗保健设施中使用的防护服和防护布的液体阻挡层性能和分类》。企业申请上市前登记,一般都需要根据ANSI/AAMI PB70对防护服进行性能测试。
In 2004, FDA approved ANSI / AAMI pb70, liquid barrier performance and classification of protective clothing and protective cloth used in health care facilities. When applying for pre listing registration, enterprises generally need to test the performance of protective clothing according to ANSI / AAMI pb70.
须获得欧盟CE认证,并符合技术法规:(EU)2016/425
2016年3月9日,欧盟通过了个人防护装备(PPE)法规(EU) 2016/425,该法规撤销并替代了PPE指令89/686/EEC,于2018年4月21日正式实施,并指出2019年4月21日之后投放市场的产品必须满足(EU)2016/425中所有的要求,该法规覆盖防护服、呼吸防护设备、手套等防护产品的安全监管。此期限,出口外贸企业和生产企业须重点注意。
根据法规(EU)2016/425第8条,出口欧盟的防护服制造商需要:
1.确保其产品符合法规附件Ⅱ列出的基本健康及安全要求;
2.撰写法规附件Ⅲ所述的技术文件;
3.进行适用的合规评估程序;
4.撰写欧盟合规声明;
5.按照法规在产品贴附CE标记;
6.在个人保护装备标明制造商的名称、注册商号或注册商标、地址等;
7.确保个人保护装备附有类型、批次或序列编号,以便识别;
8.撰写使用说明,与个人防护装备一并提供。说明书必须包含制造商的名称及地址,以及可以连接到欧盟合规声明的互联网址。若欧盟合规声明是随个人防护装备附上,说明书则无需包含互联网址。
个人防护装备投放市场后10年内,制造商必须保存其技术文件及欧盟合规声明。
如需投放市场产品,必须符合日本PharmaceuticalandMedicalDeviceAct(PMDAct)要求,TOROKU注册系统要求外国厂商向PMDA注册制造商提供信息。
日本的政府机构主要是制定法律法规和进行宏观管理,具体业务工作很多都交给各类行业协会来做。防护服涉及的主要行业协会为日本安全设备协会(JSAA)和日本防护服协议会(JPCA)。
http://jsaa.or.jp/
http://bougofuku.net/index.html
● 日本医药品和医疗器械综合机构(PMDA)网址:
www.pmda.go.jp
韩国
2020年1月15日,韩国劳动部2020-35日发布《防护设备安全认证通知》,提出化学防护服、防尘口罩等性能标准和测试方法。根据《防护设备安全认证通知》中防护服性能标准的内容,防护服分为六类( 类分为五类)。类别见下表:

《防护设备安全认证通知》全文可在http://www.law.go.kr/%ED%96%89%EC%A0%95%EA%B7%9C%EC%B9%99/%EB%B3%B4%ED%98%B8%EA%B5%AC%EC%95%88%EC%A0%84%EC%9D%B8%EC%A6%9D%EA%B3%A0%EC%8B%9C下载
须通过澳洲的TGA注册,TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,分别为豁免、备案和注册。无论哪类医疗器械,其上市销售前必须得到澳大利亚政府的准许,符合医疗器械的基本要求,按照符合性审查程序进行审查。
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由TGA颁发的也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册一次,说明产品型号、性能及质量有无变化。TGA 全权负责对医疗器械的符合性评价,并收取一定费用,相关费用金额可参见 TGA的网站。
www.tga.gov.au
● 2002年《医疗器械法规》下载链接:
https://www.legislation.gov.au/Series/F2002B00237
六、各国防护服技术标准简析:
美国防护服标准:
1、ANSI/AAMIPB70:2003(2012)《医疗保健设施中使用的防护服和防护布的防液性能和分类》
2、ASTMF1670-2017《防护服装阻止血液渗透试验方法》
3、ASTMF1671/F1671M-2013《噬菌体穿透性作为试验系统测定防护服材料抗血液携带病原体穿透性的试验方法》
美国市面销售上的防护服也常用ANSI/AAMI PB70的4个级别对产品测试分类。各级别的阻隔性要求见下表。
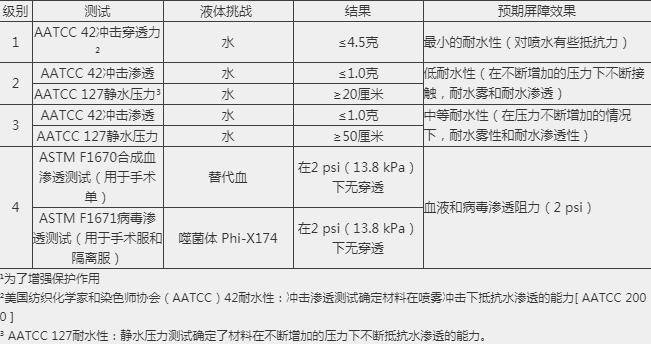
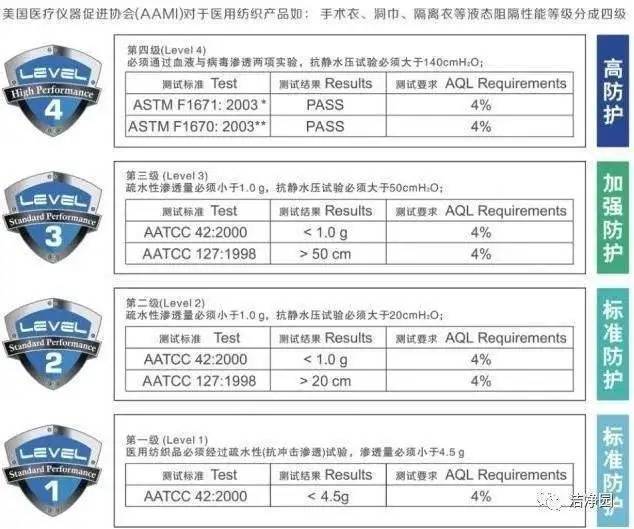
对于出口美国抗击新冠病毒防护服的标准说明:
从以上表格中看到,级别1、2和3的要求具有与之相关的特定测试要求。仅对4级防护服进行了抗病毒渗透性测试,因此使用ASTM F1671仅将4级服装视为对病毒渗透不可渗透。符合较低级别(1、2和3级)的防护服不能被认为是不可渗透的,不能用在病原性防护中。只有美标4级才有能力用在此次新冠肺炎疫情的医用防护中,此类需求很大,提示外贸和生产企业可以重点关注。
欧盟防护服EN14126标准
BS EN14126 防护材料抵抗感染物质保护标准。

EN 14126:2003+AC:2004《防护服 抗感染防护服的性能要求和试验方法》标准适用于可重复的和有限使用的防护服,但不适合外科医生及手术过程中为避免交叉感染的患者穿着用。其中要求防护服的接缝处应符合EN 14325《化学药品防护服 化学防护服装材料、缝合线、联结和组合的试验方法和性能分类》中的强度要求。整套防护服按照防护性能分为6类,从type1到type6,数字越小防护越高;type 4为医用推荐要求,带“B”的类型是生物防护,一般优先选择带B类型防护服。
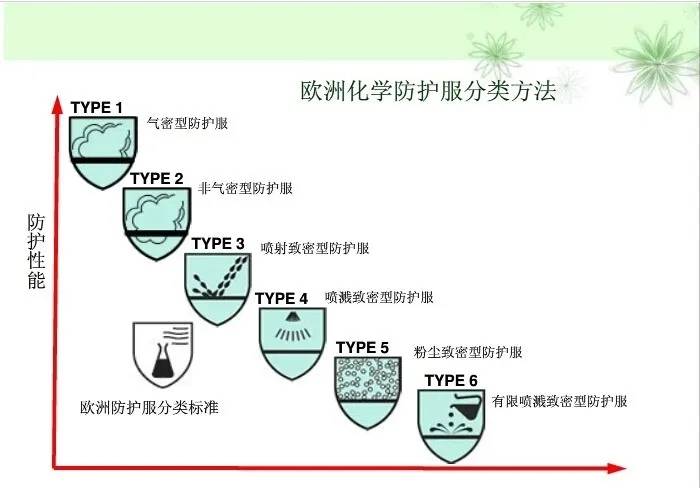
对于出口欧洲抗击新冠病毒防护服的标准说明:
根据抗击新冠疫情期间我国《 卫生健康委办公厅关于加强疫情期间医用防护用品管理工作的通知》,疫情防控期间,医用防护服不足时,医疗机构可使用紧急医用物资防护服。紧急医用物资防护服应当符合欧盟医用防护服EN14126标准(其中液体阻隔等级在2级以上)并取得欧盟CE认证,或液体致密型防护服(type3,符合EN14605标准)、喷雾致密型防护服(type4,符合EN14605标准)、防固态颗粒物防护服(type5,符合1SO13982-l&2标准)。紧急医用物资防护服仅用于隔离留观病区(房)、隔离病区(房),不能用于隔离重症监护病区(房)等有严格微生物指标控制的场所。
我国国标GB19082-2009《医用一次性防护服技术要求》 “二级以上防护服”的抗合成血液穿透等级要求是在1.75kPa压强值下无渗透,此类防护服被应用于我国医院抗击新冠肺炎疫情,将欧标与我国GB19082-2009对比,与之相对应的欧标采用的 ISO 16604标准中,同样是2级以上,故出口用做防护新型冠状病毒入侵人体的医用防护服的服装面料应该通过EN 14126认证且应该在ISO 16604、ISO 22610、ISO 22611中达到较高等级(其中ISO 16604至少2级)。
从上述我国防疫经验与中欧标准相比,可以看出抗击新冠状肺炎疫情,紧急情况下至少要使用type5级以上的欧标防护服,在医院等病毒感染风险较高的地区,使用的医用防护服至少要使用type4级以上,所以type1-5级防护服对疫情防控和病人救治的需求 大,外贸企业和生产企业都可以重点关注。
Type 6 类防护服因为对接缝处没有技术要求,所以接缝和针孔处会造成污染液体的穿透,不适用于新型冠状病毒防护。
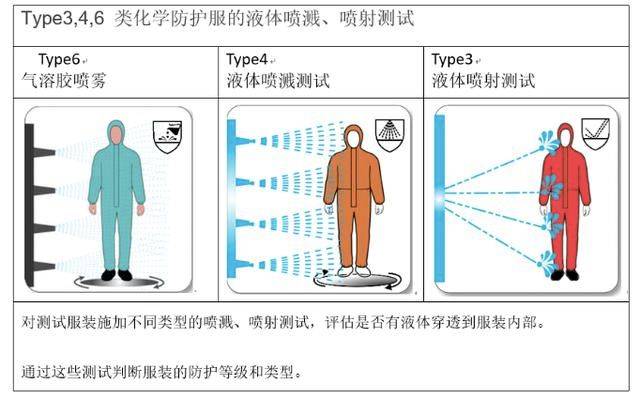
日本防护服技术标准
在日本,个人防护标准是对医疗安全用具T类标准进行分类的劳动安全范畴,其中JIS标准是日本 级标准中 权威、 重要的,属于非强制性标准。但是,如果被日本法律引用,JIS标准可以成为强制性标准。
对于出口日本抗击新冠病毒防护服的标准说明:
JIS标准中涉及防护服的有45个标准,其中日本JIS T 8122:2015(预防危险生物制剂的防护服)将化学防护服标准与抗感染防护服标准相结合,其引用核心标准为JIS T 8115(化学防护服)、JIS T 8060(防止接触血液和体液的防护服-关于防护服材质对血液和体液的耐渗透性能的测定方法-使用人工血液的试验方法)、JIS T 8061(防止接触血液和体液的防护服-关于防护服材质对血液媒介性病原体的耐渗透性能的测定方法-使用Phi-X174噬菌体的试验方法)。故符合日本JIS T 8122:2015标准的防护服可适用于抗击新冠肺炎疫情的医疗和救治,外贸企业和生产企业可重点关注。
There are 45 standards related to protective clothing in JIS standards, among which Japanese JIS t 8122:2015 (protective clothing against dangerous biological agents) combines chemical protective clothing standards with anti infection protective clothing standards, and its core standards are JIS t 8115 (chemical protective clothing) JIS t 8060 (protective clothing against contact with blood and body fluids - Method for determining the permeability resistance of protective clothing materials to blood and body fluids - Test method using artificial blood) JIS t 8061 (protective clothing against contact with blood and body fluids - Method for determining the permeability resistance of protective clothing materials to blood borne pathogens - Test method using Phi-X174 phage). Novel coronavirus pneumonia that meets the Japanese JIS T 8122:2015 standard can be applied to fight the new crown pneumonia epidemic situation, and foreign trade enterprises and production enterprises can focus on it.
七、各国防护服生产技术标准:
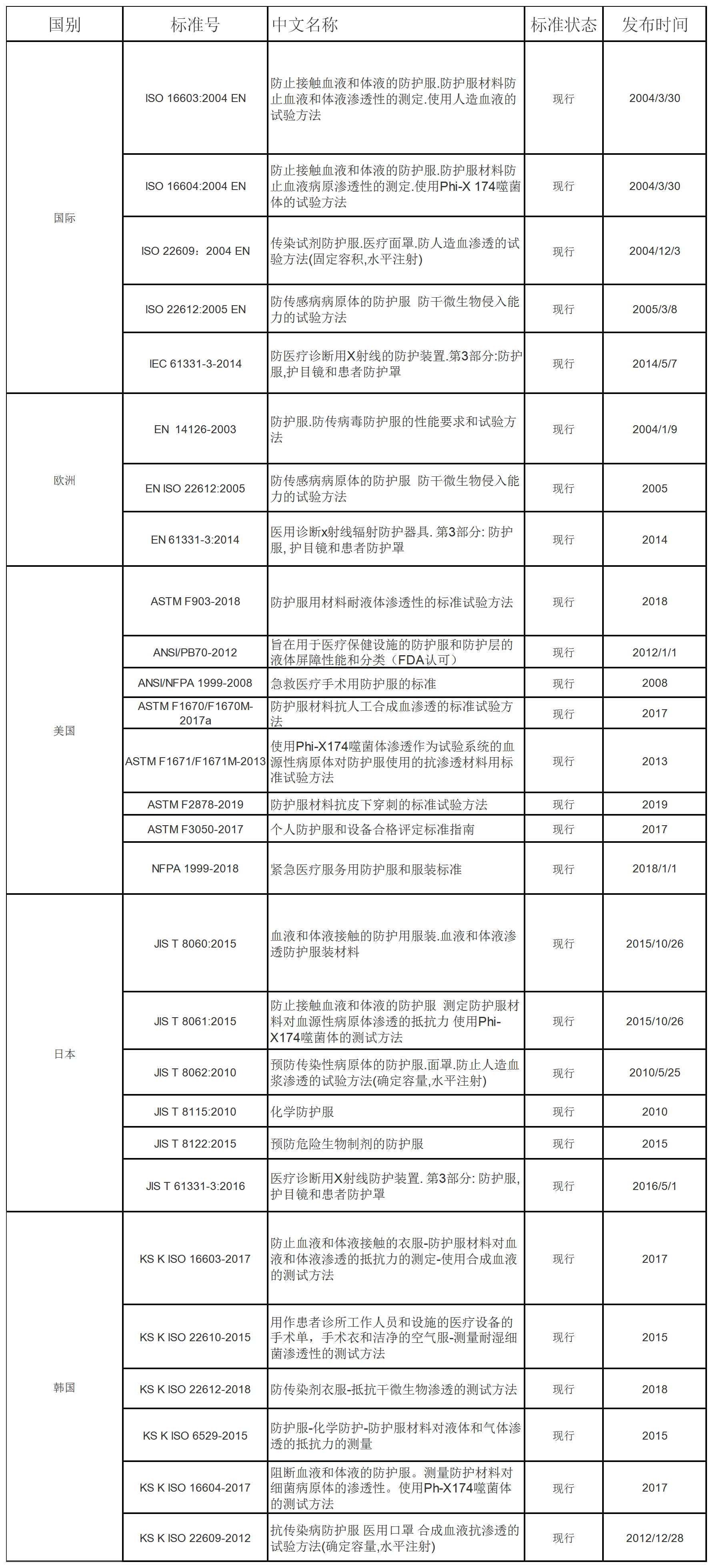
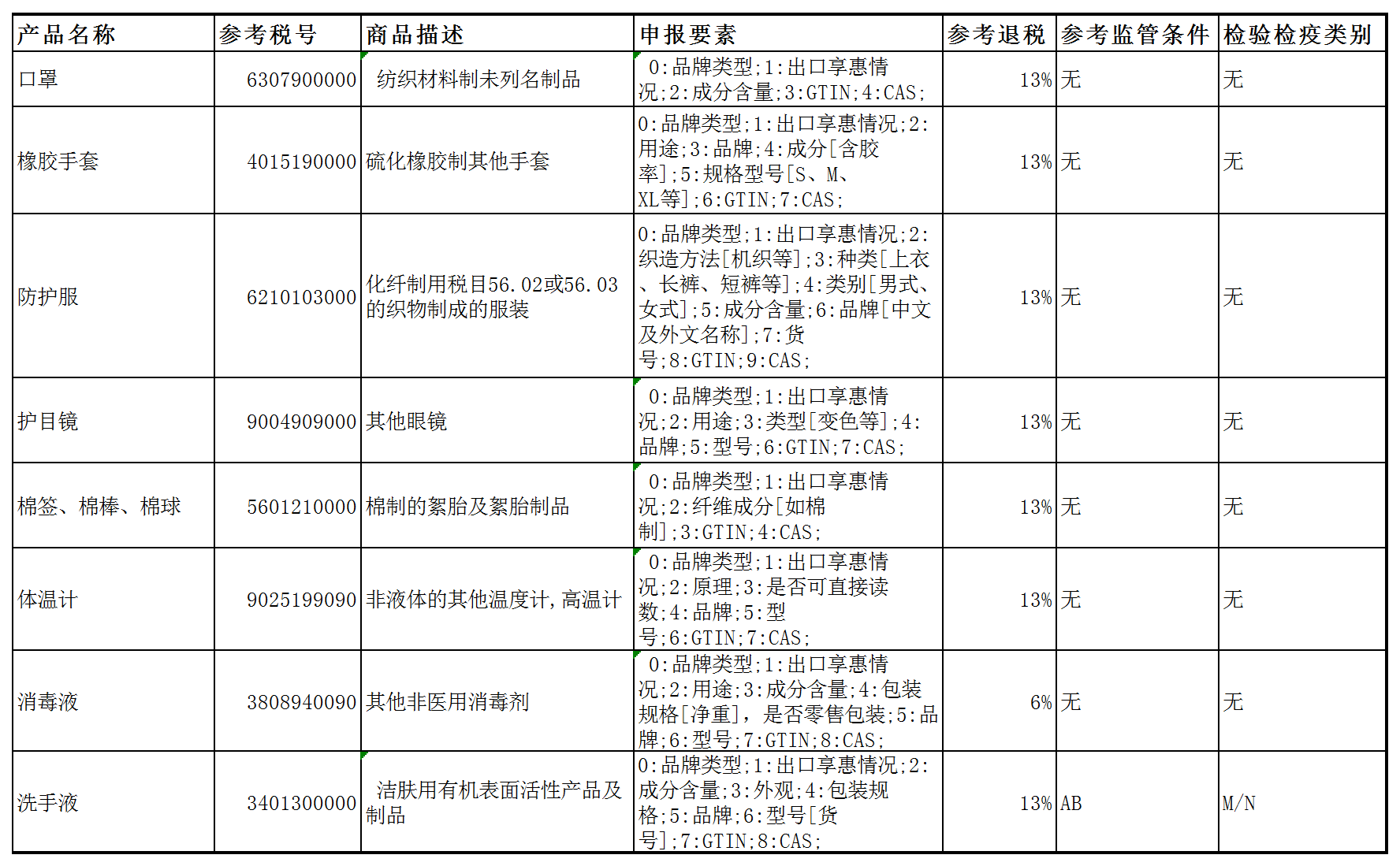
防疫物资出口监管表